- 会員限定
- 2018/04/19 掲載
ペプチドリーム 窪田規一会長に聞く「発明者がビジネスに携わらない」理由
連載:「オープンイノベーション」の実際
-
|タグをもっとみる

「バイオベンチャーは赤字」を覆したい
――まずはペプチドリームの立ち上げ経緯をお聞かせください。窪田氏:2005年に東京大学エッジキャピタル(UTEC)を通して、私に社長の依頼があり、菅教授と出会ったのが始まりです。当時、経済産業省による「大学発ベンチャー1000社構想」を受け、東京大学に特許化する技術を使ってベンチャーを立ち上げようとする動きがありました。
そこで、先端科学技術センターの教授であった菅裕明氏(現在は理学系研究科化学専攻教授)が開発した画期的な発明(人工のRNA触媒「フレキシザイム」)に「東京大学TLO」が関心を示し、UTECが社長となる人材を探していたのです。なお、「東京大学TLO」とは、東京大学で生まれた技術の産業界への窓口を担う組織です。
菅教授とは薬を作って社会貢献したいということで一致し、創薬の取り組みを変える根本から可能性がある「特殊ペプチド創薬」に挑むことが決まりました。
これまでも同じような試みは行われていた(自然界から偶然見つかった物質がさまざまな治療に適用できる「特殊ペプチド(※1)」の構造を持っていることが分かっており、創薬のために特殊ペプチドを人工的に作る研究開発がされていた)のですが、成功していませんでした。
それが、菅教授が開発した発明(フレキシザイム)を使うことで実現できる可能性があると分かったのです。
※1 体内ですぐに分解されない特殊なペプチド。複数のアミノ酸の化合物であるペプチドは、生体内でホルモンや各種の信号の”メッセンジャー”の役割を果たすなど、薬の候補として有力だったが、体内ですぐ分解される特質があり、薬として不十分だった。
「分解されない特殊なペプチド」は自然界に存在するものの発見が難しく、「すぐに分解されない特殊ペプチドの構造を真似た人工物」を作るのは非常に困難とされていた。これは、ペプチドを構成するアミノ酸の組み合わせを「書き換える」のは不可能とされていたためだ。
菅教授はこの組み合わせを書き換える発明(人工のRNA触媒「フレキシザイム」)をし、「特殊ペプチド」を生成する道筋を立てた。
最初は2人でビジネスモデルを作り上げ、独自に資金を集めてスタートしました。その後、ずっとコンタクトを取ってくれていたUTECに声をかけられ、出資頂くことになりました。
特殊ペプチド創薬をすると決めてからは、薬の開発という1つのシステムを作るために必要な技術を研究し、2006年の会社設立から2010年までの間に、7つの特許をコアとした特許のポートフォリオ(資産群)を組み立てました。
その当時、バイオベンチャーは赤字が当たり前でした。外から調達した多額のお金で研究を進めていたのです。私たちはこのスタイルを否定して、黒字のベンチャーを立ち上げ、なるべく資金調達をしないで自分たちの力で経営することを大きな目標としました。
薬の世界は「オンリーワンであること」
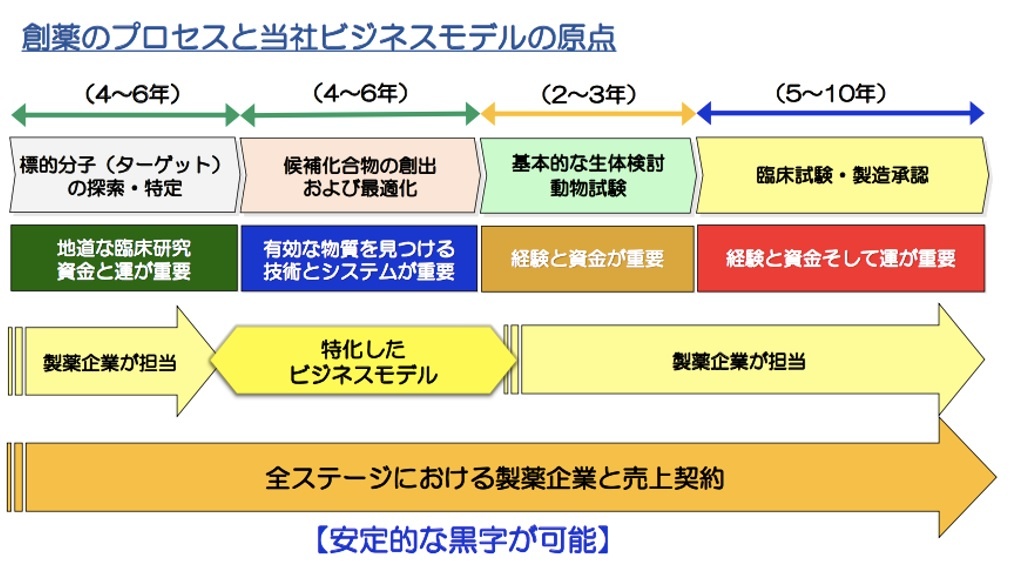
――黒字のベンチャーとなるためには収益を上げる必要がありますよね。窪田氏:今までのバイオベンチャーは、開発の鍵となる「ターゲット(標的分子)」の探索から臨床試験の段階まですべて自分たちで担い、製薬会社にPoC(概念実証)を提供することで、初めて契約が成立するスタイルでした。
しかし我々は、特殊ペプチドを人工的に作る世界初の技術に特化し、独自の創薬開発プラットフォームシステムであるPDPS(Peptide Discovery Platform System)(※2)を構築したのです。
※2 創薬探索プラットフォーム。創薬に有効な発明(フレキシザイム技術)と組み合わせることで、(創薬の際の開発に有効な)400種類以上の特殊アミノ酸を使用できるようになり、「無限大に近い」種類のペプチドを合成することが可能になる。「候補化合物の創出および最適化」に特化している(※2018年6月期 第二四半期決算説明会資料から編集)。
最初のターゲットの探索・特定と、後半での動物試験・臨床試験はクライアントに任せ、我々は「候補化合物の創出および最適化」に集中することにしました。
ですから「請負」ではなく、製薬企業とは「パートナーシップ」という形を取っています。研究開発費用や、それ以降のプロセスでも、成功したポイントごとに報酬が(製薬企業から)支払われます。さらに、薬がマーケットに投下されたら、一定のロイヤリティをもらう契約です。
従来のバイオベンチャーのモデルでは、お金がかかりますし、試行錯誤しながら進めるため、年に1~2本程度しかプロジェクトができません。しかし、我々はコンスタントに50~60本のプロジェクトを実施しています。
最初に条件を決めて契約を結んでいるため、プロジェクトが失敗しない限りは、いつかはすべてのお金が手に入る仕組みです。なるべく多くのプロジェクトを受託することで、1本から2本が失敗しても挽回できるようにしています。
――バイオベンチャーにとっては魅力的なビジネスモデルですが、クライアントにとってはリスクもあります。なぜ認められるのでしょうか。
窪田氏:世界中の製薬メーカーが特殊ペプチドに興味を持っているなかで、「PDPS」という、他には真似できない創薬プロセスの1つのパーツを作り上げたのが大きな要因です。
創業当時のマーケットを見ると、医薬品の主役は「低分子」と「抗体」の2つのアプローチが一般でした。低分子はほとんど新しいものは出てこない状態で、抗体は2005年頃がちょうど最盛期でしたが、アカデミックな観点では限界が見えていました。
そのため、「次世代の医薬品は特殊ペプチドで作ろう」というストーリーが作れたのです。
そのうえで、今までのバイオベンチャーの失敗を徹底的に分析し、自分たちが得意な分野に特化して、第三者に評価される見せ方を作り上げました。
今契約している企業はすべて、クライアント側からオファーを頂いています。
ビジネスには売る人と買う人がいます。売り手がたくさんいて、同じようなものを売ろうとしていたら、買い手は自由に選べますが、売り手が一人なら、売り手に自由があります。
その状況を作り上げたのが、技術的なパテント(特許)のポートフォリオでした。
我々が何兆円も売り上げている企業と共同研究をできているのは、この技術を我々しか持っていないからです。薬の世界ではベストワンではなく、オンリーワンでなければなりません。
また、菅研究室が非常に優秀だったため、論文や学会で認められる発表をしていたことも大きいと思います。技術研究の段階から、海外の製薬メーカーと部分的にコラボレーションできました。 理想的なアカデミアとビジネスの関係だと思います。
今は、PDPSをデファクトスタンダードにするために、世界の大手製薬メーカーにPDPSのライセンスをして、実績に対してマージンを頂くビジネスもしています。特許が切れた時にPDPSを真似される可能性はありますが、独占しているうちにデファクトスタンダードになれば奪われることはありません。
【次ページ】発明者はビジネスに口を出すな
PR
PR
PR