- 2024/11/15 掲載
欧州医薬品庁、エーザイと米バイオジェンのアルツハイマー病治療薬の条件付き販売承認を勧告
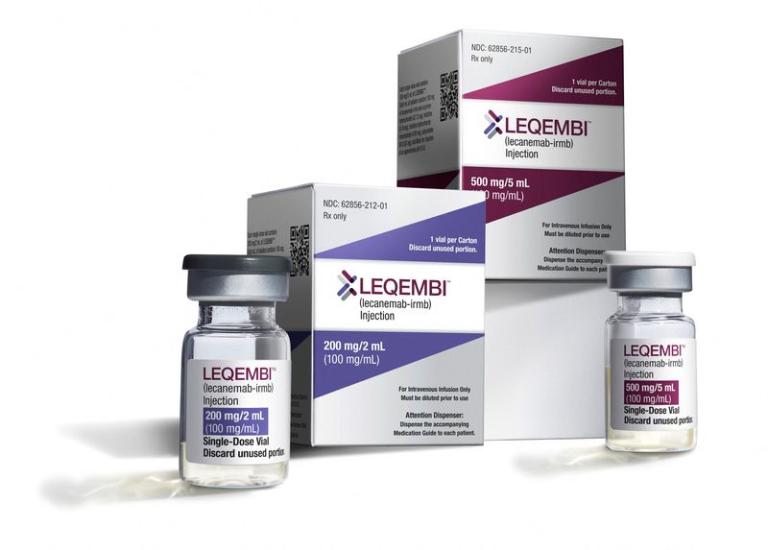
[14日 ロイター] - 欧州連合(EU)の医薬品規制当局の欧州医薬品庁(EMA)は14日、製薬大手エーザイと米医薬品大手バイオジェンが開発したアルツハイマー病治療薬「レカネマブ」の販売を条件付きで承認するよう勧告した。EU欧州委員会が勧告を受理した場合、レカネマブはEU初のアルツハイマー病治療薬となる。
EMAの下部組織である欧州医薬品評価委員会(CHMP)は初期症状の一部患者向けという条件付きでの承認を勧告しており、レカネマブの臨床試験で対象とした患者群よりも狭い範囲となる。
ただ、EMAは今年7月にはレカネマブの認知機能低下を遅らせる効果が脳腫脹や脳出血などの重篤な副作用が起きるリスクに見合わないとして販売承認しないように勧告しており、判断が一転した形だ。
エーザイとバイオジェンは、アルツハイマー病の発症に関連する「APOE4」という遺伝子が全くないか、1つ持っている初期症状の患者に加え、APOE4が2つある患者も臨床試験の対象とした。
EMAは試験結果を踏まえた今回の再審査で、APOE4が全くないか、1つある患者の認知機能低下を遅らせる効果は、副作用のリスクを上回ると判断した。これらの患者群では脳腫脹や脳出血などの重篤な副作用が起きるリスクが低いとの見方を示した。
一方、APOE4が2つある患者については承認を勧告しなかった。米国ではAPOE4が2つある患者向けにも承認されている。
再審査では1795人の患者の試験結果を検証し、うちAPOE4が全くないか、1つある患者は1521人だった。
ジェフリーズのアナリスト、マイケル・イー氏はレカネマブのピーク時の売り上げのうちEUが最大30%を占める可能性があると指摘。ただ、レカネマブは追加の診断テストが求められていたり、使用者が脳を定期的にスキャンする必要があったりと、発売に当たって他の課題もあると言及した。
関連コンテンツ
PR
PR
PR